Alles wat patiënten moeten weten over Aduhelm (aducanumab) | New Alzheimer's Medicine
Laatst bijgewerkt: 15 maart 2022

U kunt legaal toegang krijgen tot nieuwe geneesmiddelen, zelfs als ze niet zijn goedgekeurd in uw land.
Leer hoeArtikel beoordeeld door Dr. Jan de Witt
Op 7 juni 2021 keurde de FDA aducanumab (geproduceerd onder de handelsnaam "Aduhelm") goed voor de behandeling van de ziekte van Alzheimer. Dit wekte de hoop van miljoenen Alzheimerpatiënten en hun families over de hele wereld, terwijl experts hun bezorgdheid uitspraken over het besluit.
Aduhelm is het eerste geneesmiddel voor de ziekte van Alzheimer dat door de FDA wordt goedgekeurd in 18 jaar Dit geneesmiddel beweert, volgens de gepubliceerde resultaten, in staat te zijn om de progressie van de ziekte van Alzheimer zelf te vertragen, in plaats van de symptomen ervan te verlichten.
De beslissing van de FDA om het medicijn goed te keuren is omgeven door controverse. Niettemin verwacht Biogen, de fabrikant van Aduhelm, Aduhelm tegen eind juni 2021 te kunnen leveren aan meer dan 900 gezondheidszorgcentra in de Verenigde Staten.
Aduhelm is momenteel beschikbaar voor geschikte patiënten buiten de Verenigde Staten op basis van compassionate use of op naam van de patiënt. Lees meer door te springen naar de sectie "Toegang tot Aduhelm buiten de Verenigde Staten".
De ziekte van Alzheimer: een van de grootste sociale, medische en economische crises van de 21e eeuw
De ziekte van Alzheimer is een degeneratieve hersenaandoening die vandaag de dag meer dan 40 miljoen mensen over de hele wereld treft en de meest voorkomende oorzaak van dementie is. De ziekte van Alzheimer werd jarenlang beschouwd als een normaal onderdeel van het ouder worden, maar wordt nu erkend als een aandoening met ernstige gevolgen voor de gezondheidszorg, de economie en de maatschappij.
Onderzoekers begrijpen nog niet volledig wat de ziekte van Alzheimer veroorzaakt, maar men denkt dat het veroorzaakt wordt door een combinatie van factoren, zoals:
- Veroudering: Alzheimer wordt het vaakst gediagnosticeerd na het 65e levensjaar (late Alzheimer). Ongeveer een derde van de mensen van 85 jaar en ouder heeft de ziekte van Alzheimer. Veranderingen in de hersenen die verband houden met het ouder worden, kunnen bijdragen aan het ontwikkelen van de aandoening.
- Familiegeschiedenis: Het hebben van een eerstegraads familielid met Alzheimer verhoogt het risico dat iemand de ziekte krijgt. Wetenschappers denken dat een genetische aanleg de vroege vorm van Alzheimer kan veroorzaken, die optreedt bij mensen tussen de 30 en midden 60 jaar. Slechts 10% van de Alzheimerpatiënten heeft de vroege vorm van de ziekte.
- Andere factoren: Wetenschappers hebben verbanden gevonden tussen cognitieve achteruitgang en hartaandoeningen, evenals diabetes en obesitas. Het sterkste bewijs verbindt de gezondheid van de hersenen met de gezondheid van het hart. Verwondingen aan het hoofd zijn ook in verband gebracht met een verhoogd risico op Alzheimer, omdat ze de vorming van amyloïde plaques kunnen veroorzaken. Mensen met het syndroom van Down, waarbij een extra chromosoom de genetische codering bepaalt voor een type amyloïde eiwit dat in verband wordt gebracht met Alzheimer, lopen ook een verhoogd risico.
De meeste mensen met Alzheimer krijgen de diagnose in het milde stadium, wanneer de symptomen duidelijker worden en de ziekte al enige schade aan de hersenen heeft aangericht, ondanks het feit dat sommige symptomen zich al tien jaar voor de diagnose beginnen voor te doen. Vroege symptomen worden soms genegeerd door patiënten (vaak uit schaamte) of gewoon niet opgemerkt door artsen of familieleden. Patiënten hebben een gemiddelde levensverwachting van 3-11 jaar na de diagnose.
"Na verloop van tijd vergat mama wie ik was.
De ziekte van Alzheimer kent drie verschillende stadia:
- Mild: In de eerste stadia ervaren patiënten geheugenverlies zoals het vergeten van belangrijke data en gebeurtenissen, het vaak herhalen van vragen, het langer duren om dagelijkse taken af te ronden, constante problemen met financiën, het vaak kwijtraken van voorwerpen en angst. (Voor meer informatie over hoeveel geheugenverlies normaal is bij het ouder worden, zie deze infographic van het National Institutes of Health (NIH)'s National Institute on Aging).
- Matig: Naarmate de ziekte vordert, hebben patiënten meer geheugenverlies en verwardheid, moeite met communiceren en lezen, moeite met routinetaken zoals aankleden, problemen met het herkennen van familie en vrienden, paranoia, hallucinaties en dwalen.
- Ernstig: Patiënten met ernstige Alzheimer kunnen niet meer communiceren, hebben gewichtsverlies, moeite met slikken en hebben geen controle meer over hun darmen of blaas. In dit stadium liggen patiënten het grootste deel van de tijd in bed en zijn ze voor hun verzorging volledig afhankelijk van anderen.
De ontberingen van Alzheimerpatiënten zijn schrijnend, omdat de ziekte elk aspect van hun dagelijks leven beïnvloedt. Hieronder kun je enkele verhalen lezen van patiënten of van vrienden en familie van patiënten.
Sandy, een voormalig tandarts en assistent-professor aan Harvard, sprak met verslaggevers van CNN over zijn realisatie dat zijn vergeetachtigheid was uitgegroeid tot iets ergers: "'Ik kijk anderhalf uur naar een tandartsdossier,' herinnert hij zich. Ik lees het, het zit in mijn hersenen. Dan sluit ik het dossier en herinner ik me letterlijk niets meer van de zaak.'" Kort daarna kreeg hij de diagnose Alzheimer.
Fred Walker, wiens vrouw de diagnose Alzheimer heeft gekregen, sprak met Alzheimer's Research UK over zijn vrouw: "'De telefoon gebruiken ging haar pet te boven. Ze kon niet alle knoppen bedienen. Het fornuis was veel te ingewikkeld om te begrijpen en er was altijd het gevaar dat ze het gas aan liet staan. Ze vond het zetten van een kopje thee te veel en raakte in de war over hoeveel thee, melk en water er nodig was.""
De ziekte van Alzheimer, wanneer deze de latere stadia bereikt en overgaat in dementie, wordt beschreven door Laury voor de Alzheimer's Society:
"[...] we begonnen aan een nieuwe reis. Een reis die 24 uur per dag zorg, dagelijkse medicatierondes en moeder die volledig verdwaalde in de mist van haar eigen geest met zich meebracht. [...] Tot op dat moment drong het niet door hoe gruwelijk het was om een geliefde met deze wrede, verraderlijke ziekte te zien. [Ze begon te hallucineren."
everyone.org oprichter Sjaak Vink bevestigt en herkent elk van deze beschrijvingen. Zijn moeder kreeg in 2015 de diagnose Alzheimer.
Het is een moeilijke weg voor patiënten en hun dierbaren - en de ziekte heeft niet alleen invloed op hun persoonlijke leven en dat van hun dierbaren.
Druk op verzorgers, budgetten en beleidsmakers
Patiënten met Alzheimer hebben steeds zwaardere zorg nodig naarmate hun toestand verslechtert, zoals thuiszorg, nachtzorg, huishoudelijke hulp of verpleging. De ziekte eist een zware tol van de patiënt, van hun familieleden (die zich vaak volledig wijden aan de zorg voor de patiënt) en van hun persoonlijke en overheidsbudgetten.
Mantelzorgers staan voor een moeilijke taak wanneer ze voor hun dierbaren met de ziekte van Alzheimer zorgen. Uit een onderzoek bleek dat 95% van de mantelzorgers in het Verenigd Koninkrijk zegt dat het hun lichamelijke of geestelijke gezondheid heeft beïnvloed, 69% gaf aan zich constant uitgeput te voelen, 64% voelde zich angstig en 49% voelde zich depressief.
In Europa lijden ongeveer 10 miljoen mensen aan de ziekte van Alzheimer en andere vormen van dementie en dit aantal zal naar verwachting toenemen tot 14 miljoen in 2030. De economische kosten van dementie in Europa zullen tegen 2030 naar schatting oplopen tot meer dan 250 miljard euro, waarvan meer dan 50% voor rekening komt van mantelzorgkosten. Er is ongelijke toegang tot zorg en behandeling en, vooral in Oost-Europa, is er een gebrek aan beschikbare ondersteuningssystemen en sociale programma's voor Alzheimerpatiënten en hun verzorgers.
In de Verenigde Staten staat de ziekte van Alzheimer sinds kort in de top 10 van doodsoorzaken en het is de enige in de top 10 waarvoor geen behandeling bekend is. In de VS lijden 6 miljoen mensen aan de ziekte en dit aantal zal naar verwachting toenemen tot 12 miljoen in 2050. Tegen het einde van 2021 kunnen de totale nationale kosten voor de zorg voor mensen met Alzheimer en andere vormen van dementie oplopen tot 355 miljard dollar en tegen 2050 zullen ze naar verwachting zijn opgelopen tot 1,1 biljoen dollar.
Deze financiering, hoe astronomisch deze ook mag lijken, is nodig om patiënten adequate ondersteuning te bieden en, voor zover mogelijk, een waardig leven.
Vanwege de zorg die 24 uur per dag nodig is, vooral in de latere stadia, worden patiënten met Alzheimer vooral getroffen wanneer hun zorg ontoereikend is, wat in veel landen of gemeenschappen het geval is. Alleen al in het Verenigd Koninkrijk worden jaarlijks tienduizenden mensen met dementie opgenomen op de spoedeisende hulp vanwege infecties, valpartijen en uitdroging als gevolg van ontoereikende zorg. Dit zet de nationale budgetten voor gezondheidszorg nog meer onder druk.
Tijdens de COVID-19 pandemie zijn Alzheimerpatiënten zwaar getroffen en hebben ze een hoge sterfte geleden als gevolg van leeftijd, andere langdurige gezondheidsaandoeningen en de uitdagingen van Alzheimer zelf (bijv. geheugenproblemen en verwarring waardoor patiënten moeite hebben om richtlijnen op te volgen die COVID-19-infecties voorkomen).
Alzheimerpatiënten in verzorgingstehuizen hebben de schadelijke gevolgen ook op andere manieren gevoeld. Door de ontoereikende zorg en de gedwongen scheiding van hun geliefden om hen te beschermen tegen COVID-19, heeft de daaruit voortvloeiende eenzaamheid en isolatie hun geestelijke en lichamelijke gezondheid verder verslechterd.
Effectieve behandelingen voor de ziekte zijn nodig om ook te voorkomen dat de gezondheids- en economische crisis ernstige proporties aanneemt.
Hoogtepunten in het onderzoek naar de ziekte van Alzheimer
In 1910 vernoemde Emil Kraepelin, een arts in Duitsland, de aandoening "ziekte van Alzheimer" naar de arts Alois Alzheimer, die pathologische kenmerken van preseniele dementie ontdekte bij een patiënt met ernstig geheugenverlies en verergerende psychologische veranderingen. Het onderzoek naar behandelingen voor de ziekte van Alzheimer begon pas aan het eind van de jaren 1980 in de Verenigde Staten, maar kreeg te maken met kritiek omdat artsen nog steeds geloofden dat Alzheimer een onvermijdelijk gevolg van veroudering was.
In de Verenigde Staten begonnen het National Institute on Aging (NIA) en de Alzheimer's Association in 1978 in samenwerking met Pfizer het eerste klinische onderzoek naar een geneesmiddel dat de symptomen van de ziekte van Alzheimer zou behandelen. Het medicijn werd in 1993 goedgekeurd: Cognex (tacrine) verbeterde volgens de gepubliceerde resultaten de cognitieve vaardigheden bij sommige patiënten, maar stopte niet dat de ziekte erger werd.
In het volgende decennium werden nog zes geneesmiddelen goedgekeurd, allemaal voor de behandeling van de cognitieve symptomen van de ziekte van Alzheimer:
- Aricept (donepezil): voor de behandeling van symptomen die verband houden met het geheugen en het denken
- Razadyne (galantamine): voor de behandeling van symptomen die verband houden met geheugen en denken
- Exelon (rivastigmine): voor de behandeling van symptomen die verband houden met het geheugen en het denken
- Namenda (memantine): ter verbetering van geheugen, aandacht, redeneren, taal
- Namzaric (memantine + donepezil): een combinatie van het bovenstaande
- Belsomra (Suvorexant): voor de behandeling van slapeloosheid bij patiënten met Alzheimer
Het laatste medicijn dat werd goedgekeurd voor de behandeling van de ziekte van Alzheimer werd goedgekeurd in 2003. Tientallen jaren lang werd de ziekte van Alzheimer beschouwd als een natuurlijk gevolg van veroudering. Er werden weinig middelen ingezet om een behandeling te vinden, omdat er discussie was of het wel een echte ziekte was. De afgelopen 20 jaar hebben onderzoekers echter veel middelen ingezet om de ziekte te bestuderen en een behandeling te ontwikkelen.
Het gebrek aan behandelingen voor Alzheimer is niet te wijten aan nalatigheid aan de kant van farmaceutische bedrijven - de industrie heeft over het algemeen miljarden geïnvesteerd in onderzoek. Alleen al het bedrijf Eli Lilly heeft in drie decennia 4,2 miljard dollar uitgegeven om een succesvol medicijn te ontwikkelen en de National Institutes of Health (NIH) in de Verenigde Staten hebben meer dan 500 miljoen dollar per jaar uitgegeven aan onderzoek en ontwikkeling van behandelingen.
Sinds 2013 heeft het Amerikaanse Congres het jaarlijkse NIH-budget voor onderzoek naar Alzheimer en aanverwante vormen van dementie verdrievoudigd tot 3,1 miljard dollar in 2019.
Nationale en particuliere financiering heeft geresulteerd in 2173 klinische onderzoeken die in 2019 zijn uitgevoerd om verschillende theorieën te testen. De top theorieën getest:
- 19% van de onderzoeken richtte zich op een neurotransmitterhypothese
- 17,0% van de onderzoeken testte een mitochondriale cascade hypothese en andere gerelateerde hypothesen
- 12,7% testte de taupropagatiehypothese
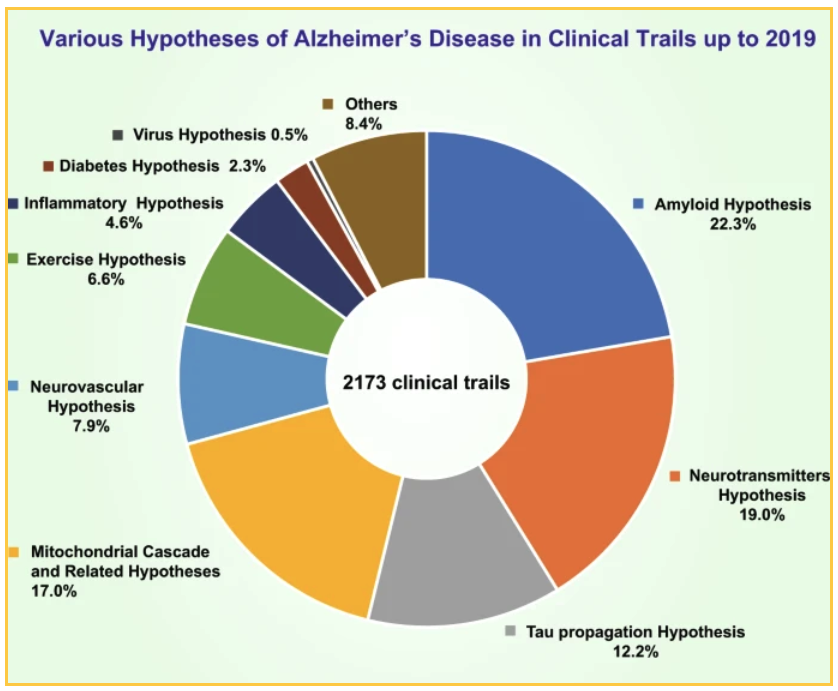
De 22,3% onderzoeken die zich richten op amyloïd richten zich op verschillende manieren om de plaque te verkleinen:
- Antilichamen tegen beta-amyloïd die door het immuunsysteem worden aangemaakt: "Actieve vaccins" die, wanneer ze in het lichaam worden geïnjecteerd, het immuunsysteem aanzetten tot het produceren van antilichamen om beta-amyloïde te vernietigen en het niveau van beta-amyloïde in de hersenen te verlagen.
- In het laboratorium geproduceerde antilichamen tegen beta-amyloïde: "Passieve vaccins", die als effectiever en veiliger worden beschouwd dan pogingen om antilichaamproductie in het lichaam op te wekken.
- De productie van beta-amyloïde verminderen: Sommige experimentele behandelingen veranderen het gedrag van bepaalde eiwitten die de productie van beta-amyloïde kunnen voorkomen of verminderen.
- Bèta-amyloïde aggregatie voorkomen: Wetenschappers onderzoeken geneesmiddelen die de eerste interacties tussen beta-amyloïde en hersencellen, die leiden tot de dood van de hersencel, voorkomen.
- De verwijdering van beta-amyloïde verhogen: Technieken zoals het mobiliseren van het immuunsysteem om het beta-amyloïde aan te vallen of het toedienen van natuurlijke stoffen met anti-amyloïde effecten.
- Natuurlijke stoffen met anti-amyloïde effecten: Intraveneus immunoglobuline (IVIg) verkregen van menselijke bloeddonoren bevat natuurlijke antilichamen die de bèta-amyloïdspiegel kunnen verlagen.
Wat is Aduhelm aducanumab-avwa)?
Aduhelm (aducanumab) is een antilichaam tegen amyloïd dat is aangewezen voor de behandeling van de ziekte van Alzheimer. Het is ontworpen om beta-amyloïde plaques te verwijderen die zich in abnormale hoeveelheden vormen tussen hersencellen bij patiënten met de ziekte van Alzheimer, wat leidt tot de dood van de aangetaste hersencellen. Het beta-amyloïde werd geïdentificeerd in 1984 en werd al snel beschouwd als de belangrijkste oorzaak van schade aan hersencellen, terwijl in 1986 het tau-eiwit werd geïdentificeerd, een belangrijk bestanddeel van klitten en een tweede oorzaak van de achteruitgang van hersencellen.
Aduhelm is ontwikkeld door Biogen, Inc., een multinationaal biotechnologiebedrijf gevestigd in Massachusetts, Verenigde Staten. Aduhelm wordt toegediend als een maandelijkse injectie.
Aduhelm heeft een lange geschiedenis.
Het Zwitserse biotechbedrijf Neurimmune Therapeutics AG heeft in samenwerking met de Universiteit van Zürich de beschermende anti-amyloïde antilichamen geïdentificeerd bij gezonde ouderen en patiënten met langzaam voortschrijdende dementie en dit heeft geleid tot de ontdekking van aducanumab, het werkzame bestanddeel in Aduhelm. Bij patiënten met milde Alzheimer vermindert een jaar van maandelijkse intraveneuze infusies met aducanumab de amyloïde plaque, wat resulteert in een vertraging van de cognitieve achteruitgang.
Neurimmune heeft aducanumab voor de behandeling van de ziekte van Alzheimer in 2007 in licentie gegeven aan Biogen en werkt samen met Biogen aan de ontwikkeling ervan.
Hoe werkt Aduhelm ?
De ziekte van Alzheimer lijkt het resultaat te zijn van de ongebruikelijke ophoping van twee eiwitten in de hersenen: beta-amyloïde en tau. Beta-amyloïde is een eiwit dat normaal aanwezig is in de hersenen en dat bij de ziekte van Alzheimer samenklontert tot amyloïde plaques tussen de hersencellen - de amyloïdtheorie stelt dat deze plaques de hersencellen beschadigen en uiteindelijk doden. Amyloïde plaques lijken zich eerder in de ziekte te ontwikkelen, terwijl tau-tangles later in de ziekte verschijnen. Veel van het onderzoek naar een behandeling voor de ziekte van Alzheimer is gericht op het verwijderen van amyloïde plaques.
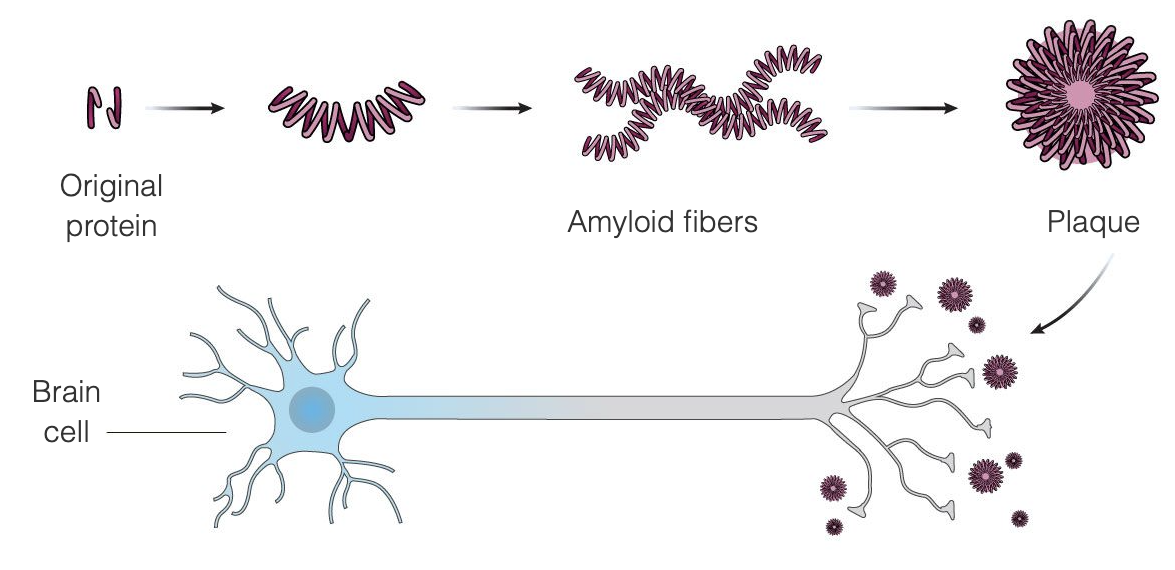
Aduhelm is ontworpen om Alzheimer in de allereerste stadia van de ziekte te behandelen door zich te binden aan de amyloïde plaques, waardoor het immuunsysteem wordt aangezet om de plaques te vernietigen, omdat het ze ziet als een vreemde indringer. De bedoeling is dat zodra de plaques zijn verwijderd, de hersencellen stoppen met afsterven en de cognitieve functie stopt met achteruitgaan. Aduhelm gebruikt dit mechanisme om de progressie van de ziekte te vertragen en richt zich met name op patiënten in de vroege stadia van de ziekte van Alzheimer. Aduhelm maakt schade die al is aangericht niet ongedaan.
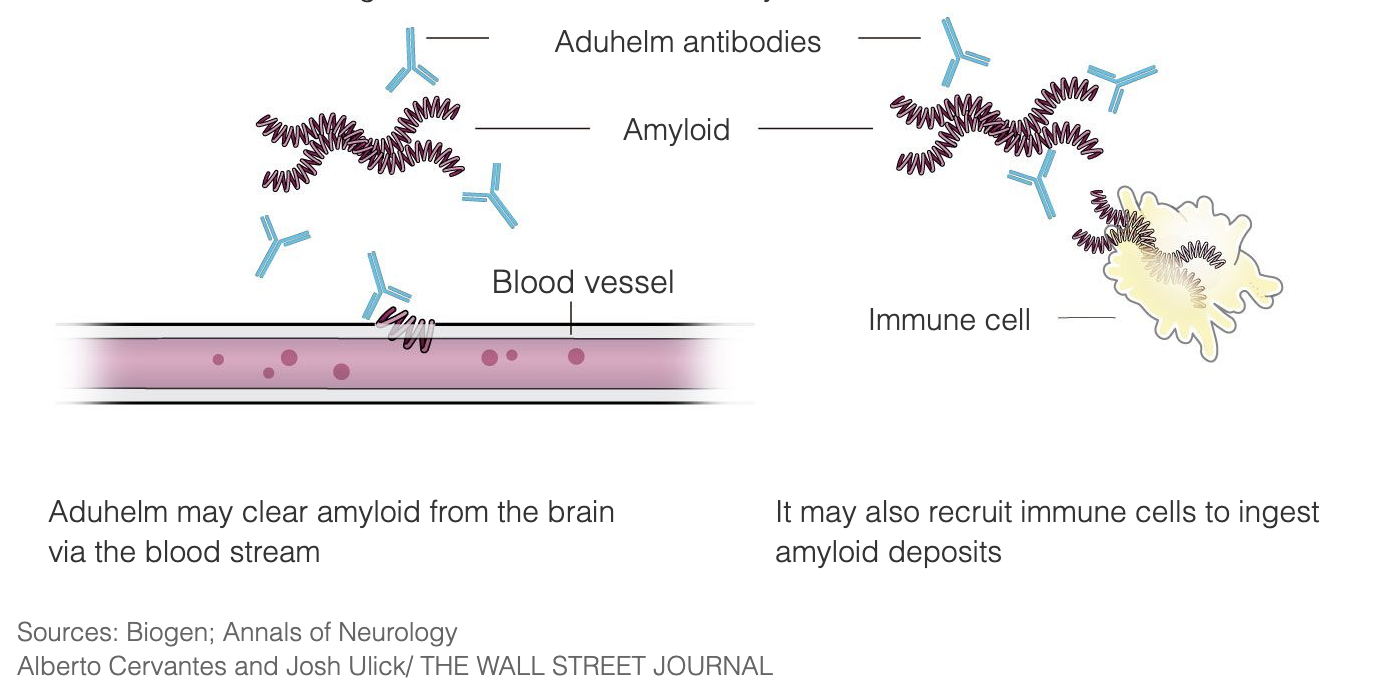
Amyloïde plaques zijn al 3 decennia lang een doelwit van onderzoek naar de ziekte van Alzheimer en de ontwikkeling van medicijnen, en Aduhelm is een van die behandelingen die in de loop der jaren zijn onderzocht.
"De kerk van de Heilige Amyloïde".
Wetenschappers zijn het nog niet eens over de oorzaak van de ziekte van Alzeimer, maar ze hebben wel bepaalde theorieën. Eén daarvan heet "de amyloïd-hypothese" en Aduhelm is ontwikkeld op basis van de veronderstelling dat deze theorie juist is.
De amyloïde hypothese stelt dat de vorming van amyloïde plaques tussen hersencellen ervoor zorgt dat de cellen afsterven, wat leidt tot cognitieve achteruitgang. Het is een aloude theorie die nooit universeel geaccepteerd is - en de mislukking tot nu toe van de klinische onderzoeken die zich richten op amyloïde plaques hebben de critici aangemoedigd. Sommigen noemen de groep aanhangers van de theorie "de Kerk van de Heilige Amyloïde" vanwege hun onwil om alternatieve theorieën te overwegen.
Zelfs de normale functie van beta-amyloïde in de hersenen wordt betwist door onderzoekers, omdat ze het niet eens zijn over welke rol het van nature speelt in het menselijk lichaam of dat het strikt een marker is van de ziekte van Alzeimer.
Een veelgehoord tegenargument voor de amyloïd-hypothese is dat er in de hersenen van veel ouderen met een normale cognitie plaques worden aangetroffen. Interessant is dat sommige postmortale onderzoeken van mensen ouder dan 90 jaar met buitengewone herinneringen in verschillende mate amyloïde plaques in hun hersenen hebben aangetoond - sommigen van hen hadden zo'n hoge dichtheid dat ze leken op de ernstigste gevallen van Alzheimer, en ze hadden ook veel meer neuronen dan mensen die met Alzheimer waren gestorven.
Sommige onderzoekers geloven dat beta-amyloïde juist een beschermende rol zou kunnen hebben.
George Perry, een neurobioloog aan de Universiteit van Texas in San Antonio, suggereert dat "ophoping van beta-amyloïde en tau eigenlijk een beschermende reactie is op leeftijdgerelateerde metabolische druk in de cel," en vooral nuttig is bij het verminderen van oxidatieve stress in de hersenen (oxidatieve stress neemt toe met de leeftijd, wat de cellen beschadigt).
Verschillende onderzoeken hebben andere mogelijke oorzaken van de ziekte van Alzheimer onderzocht. Eén zo'n onderzoek werd geleid door onderzoekers van de Icahn School of Medicine at Mount Sinai in New York, die ontdekten dat twee stammen van een virus genaamd HHV (onderdeel van de herpesvirusfamilie) in grotere hoeveelheden worden aangetroffen in de hersenen van mensen met Alzheimer. Hoewel het niet zeker is dat deze twee virussen de ziekte veroorzaken (waarschijnlijker is de combinatie van virus en een bepaalde genvariant genaamd APOE), suggereren de gegevens dat infectie het risico op het ontwikkelen van Alzheimer verhoogt en dat mensen die behandeld worden met antivirale geneesmiddelen tien keer minder kans hebben om Alzheimer te ontwikkelen.
De amyloïdtheorie wordt echter ondersteund door genetische bevindingen die een verband leggen tussen amyloïd-gerelateerde genproblemen en de ontwikkeling van de vroege Alzheimer (bij mensen tussen 30 en 65 jaar). Het syndroom van Down wordt beschouwd als een risicofactor, omdat onderzoekers hebben ontdekt dat mensen met het syndroom van Down een extra kopie hebben van een chromosoom dat het gen bevat dat codeert voor een amyloïde eiwit dat in verband wordt gebracht met de vroege Alzheimer.
Andere genetische afwijkingen kunnen leiden tot de productie van langere varianten van bèta-amyloïde die gemakkelijker plaques vormen, of de productie van bèta-amyloïde verhogen en in enigszins zeldzame gevallen de ziekte van Alzheimer op jonge leeftijd veroorzaken. Meerdere familieleden van één familie kunnen drager zijn van deze genmutaties en het risico van een persoon op het ontwikkelen van de vroege Alzheimer verhogen.
Voorstanders van de amyloïd theorie suggereren dat eerdere onderzoeken met medicijnen die gericht waren op amyloïde plaques eenvoudigweg gebrekkig waren. In een onderzoek met semagacestat bijvoorbeeld, een remmer van de productie van beta-amyloïde eiwitten, verslechterde de cognitie van de deelnemers aan het onderzoek; onderzoekers zagen ook een toename van huidkanker bij de deelnemers. Dit zou te wijten kunnen zijn aan het feit dat semagacestat ook de productie van andere eiwitten remde, niet alleen van beta-amyloïde, waarvan sommige belangrijke functies hebben in het menselijk lichaam.
De meest voor de hand liggende verklaring voor het mislukken van deze onderzoeken naar amyloïden is dat de medicijnen de juiste medicijnen zijn, maar op het verkeerde moment in de progressie van de ziekte van Alzheimer worden toegediend - ze worden te laat toegediend in het proces van de vorming van amyloïde plaques, een proces dat tientallen jaren voor het verschijnen van de symptomen begint.
Michael Murphy, een neurowetenschapper aan de Universiteit van Kentucky, merkt op dat "we waarschijnlijk al een medicijn hebben dat de ziekte van Alzheimer zou kunnen behandelen, als we het aan mensen van 50 jaar zouden geven".
Er is veel discussie over de oorzaken van Alzheimer en deskundigen zijn het nog niet eens - maar patiënten en onderzoekers hebben nieuwe wind mee gekregen door de resultaten van aducanumab in een van de klinische fase 3-onderzoeken van Aduhelm.
Aduhelm in klinisch onderzoek
Klinische onderzoeken vinden plaats in vier fasen:
- Fase 0: Het geneesmiddel wordt in zeer kleine hoeveelheden getest op minder dan 15 deelnemers om er zeker van te zijn dat het niet schadelijk is en dat het onderzoek door kan gaan.
- Fase 1: Het medicijn wordt getest op 20 tot 80 deelnemers zonder onderliggende gezondheidsproblemen om er zeker van te zijn dat er geen ernstige bijwerkingen zijn. Volgens de FDA gaat ongeveer 70% van de medicijnen door naar Fase 2.
- Fase 2: Het geneesmiddel wordt getest op enkele honderden deelnemers met de aandoening waarvoor het geneesmiddel bedoeld is gedurende enkele maanden of jaren om informatie te verzamelen over de werkzaamheid en bijwerkingen. Ongeveer 33% van de geneesmiddelen gaat over naar Fase 3.
- Fase 3: Het geneesmiddel wordt getest op maximaal 3000 deelnemers met de aandoening waarvoor het geneesmiddel bedoeld is, en kan meerdere jaren duren. Het geneesmiddel moet bewezen veilig en effectief zijn. 25-30% van de geneesmiddelen gaat door naar Fase 4.
- Fase 4: Deze fase omvat duizenden deelnemers gedurende vele jaren en vindt plaats nadat de FDA het geneesmiddel heeft goedgekeurd. Het doel is om meer informatie te verzamelen over de veiligheid en effectiviteit op lange termijn.
Aduhelm in fase 1
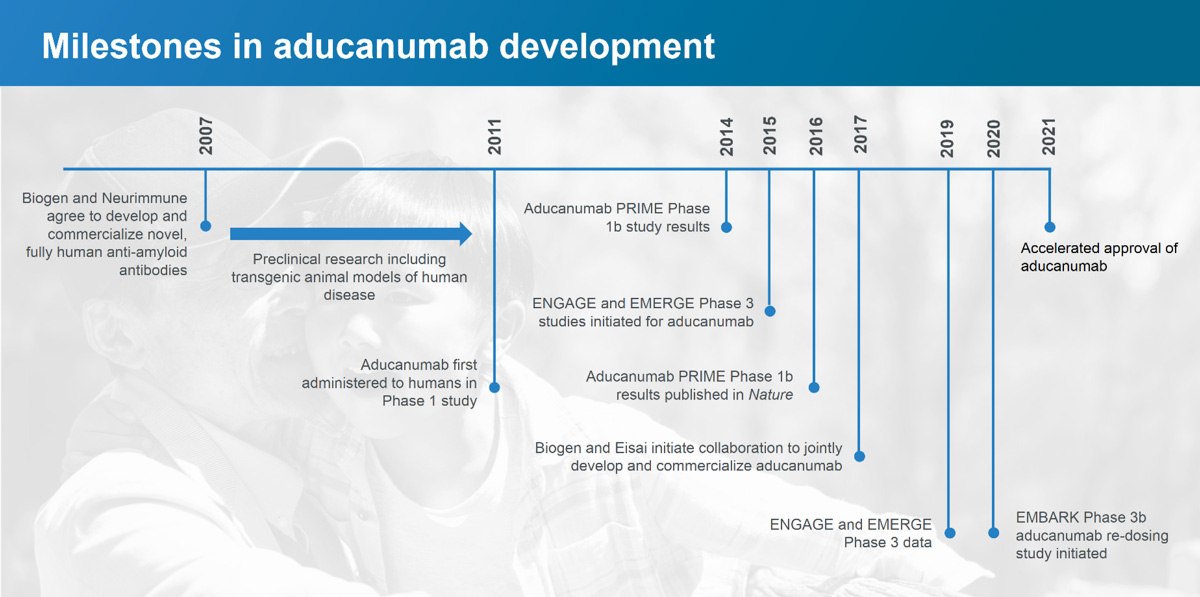
Biogen heeft verschillende klinische studies uitgevoerd om aducanumab te onderzoeken, te beginnen met drie Fase 1 studies in 2011 waarin aducanumab werd getest bij gezonde vrijwilligers en bij patiënten met de ziekte van Alzheimer in de VS en Japan, waarbij werd gewerkt met verschillende doses aducanumab en placebo. Sommige patiënten werden meer dan 3 jaar lang onderzocht.
In 2016 publiceerde Biogen de resultaten van hun Fase 1 klinische studie, waarin onderzoekers gedurende een jaar maandelijkse intraveneuze infusies met aducanumab toedienden aan deelnemers aan de studie met de ziekte van Alzheimer. Deelnemers die werden behandeld met aducanumab hadden lagere niveaus van beta-amyloïde in de hersenen en een vertraging van de cognitieve achteruitgang zoals gemeten door een officiële klinische dementiebeoordeling. Bij deelnemers die infusies met aducanumab kregen, registreerden de onderzoekers van Biogen ook een vermindering van bijwerkingen zoals ARIA (amyloïd-gerelateerde beeldvormingsafwijkingen, bijv. hersenoedeem of bloedingen in de hersenen). Biogen vond deze resultaten bemoedigend genoeg om door te gaan naar Fase 2.
Aduhelm in fase 2
Biogen begon eind 2018 met fase 2-studies en evalueerde de veiligheid van voortgezette dosering van aducanumab, naast het controleren op een vermindering van amyloïde plaques en een vertraging van cognitieve achteruitgang bij deelnemers met een vroeg stadium en symptomatische ziekte van Alzheimer.
Aducanumab slaagde er niet in het primaire doel te bereiken, namelijk een langzamere cognitieve achteruitgang na 12 maanden, maar nadat 18 maanden aan gegevens van het onderzoek opnieuw waren geanalyseerd, werden positieve effecten waargenomen bij één van de vijf doses - de hoogste dosis aducanumab. Er werd aangetoond dat de hoogste dosis de amyloïde plaques in de hersenen verminderde en ook positieve reacties op cognitie liet zien.
Bijwerkingen werden waargenomen, net als in Fase 1, zoals ARIA (amyloïd-gerelateerde beeldvormingsafwijkingen) bij ongeveer 10% van alle deelnemers, en minder dan 15% bij deelnemers die de hoogste doses aducanumab kregen.
"De 18-maanden resultaten van de BAN2401 studie zijn indrukwekkend en bieden belangrijke ondersteuning voor de amyloïd hypothese, zei Jeff Cummings, oprichtend directeur van het Cleveland Clinic Lou Ruvo Center for Brain Health, in een verklaring voor Biospace.
Aduhelm in Fase 3
Na de resultaten van de Fase 2-studie voerde Biogen twee Fase 3-onderzoeken uit, Engage en Emerge genaamd, waaraan bijna 3300 deelnemers met een relatief milde vorm van de ziekte van Alzheimer in Noord-Amerika, Australië, Europa en Azië deelnamen. Aducanumab werd eenmaal per maand toegediend in lage en hoge doses via injectie in de bloedbaan en werd vergeleken met de resultaten van deelnemers die een placebo kregen.
In maart 2019 stopte Biogen de twee Fase 3-studies, onder verwijzing naar een futiliteitsanalyse uitgevoerd door een onafhankelijke datamonitoringscommissie die concludeerde dat aducanumab niet leek te werken zoals bedoeld.
De beslissing had gevolgen voor 3300 deelnemers aan het onderzoek. De protocollen voor deelname aan de studie omvatten frequente en uitgebreide bezoeken en omvatten bloedafnames, MRI's, PET-scans en soms ruggeprikjes. Zeven maanden na het stoppen van de twee studies kondigde Biogen aan dat een heranalyse van aanvullende gegevens aangaf dat het medicijn bij hoge doses cognitieve achteruitgang leek te verminderen.
Biogen schreef in een persbericht dat de aanvullende gegevens bestaan uit resultaten van een subset van patiënten in de Fase 3 Engage studie die een hoge dosis aducanumab kregen en significante vermindering van cognitieve en functionele beperkingen (geheugen, oriëntatie, taal) ervoeren, evenals voordelen voor activiteiten in het dagelijks leven (huishoudelijke taken doen, boodschappen doen, zelfstandig buitenshuis reizen). Op basis van deze resultaten heeft Biogen in oktober 2019 wettelijke goedkeuring aangevraagd voor aducanumab en deze begin juni 2021 ontvangen.
Hoewel de klinische fase 3-onderzoeken niet volledig uitsluitsel gaven over de voordelen van de therapie met betrekking tot cognitie en functioneren, concludeerde de FDA dat de onderzoeken aantoonden dat aducanumab, geproduceerd onder de handelsnaam Aduhelm, amyloïde plaques kan verminderen, wat de basis vormde voor de versnelde goedkeuringsbeslissing van de FDA.
Deelnemer aan het onderzoek en verslaggever Phil Gutis schreef voor het nieuwsplatform Being Patient: "Ik heb via een PET-scan van een longitudinaal onderzoek ontdekt dat ik geen amyloïd meer in mijn hersenen heb. De scan, die ongeveer twee jaar geleden werd gemaakt als onderdeel van de Aging Brain Cohort studie in het Penn Memory Center, bevestigde mijn groeiende vermoeden dat aducanumab me inderdaad hielp. Ik begon het gevoel te krijgen dat ik uit een constante mentale mist aan het komen was ... Aan de negatieve kant, de herinneringen die ik kwijt was, zijn niet teruggekomen."
Bijwerkingen en contra-indicaties van Aduhelm
Volgens de medicatiegids van Biogen moeten patiënten, voordat ze Aduhelm overwegen, hun zorgverleners informeren over al hun medische aandoeningen, inclusief of ze:
- zwanger bent of van plan bent zwanger te worden
- borstvoeding geven of van plan zijn borstvoeding te geven
Patiënten moeten hun zorgverleners op de hoogte stellen van alle geneesmiddelen die ze gebruiken, waaronder receptgeneesmiddelen en vrij verkrijgbare geneesmiddelen, vitamines en kruidensupplementen.
Volgens de medicatiegids van Biogen is de belangrijkste bekende bijwerking van Aduhelm ARIA (amyloïd-gerelateerde beeldvormingsafwijkingen), zoals hersenoedeem en bloedingen in de hersenen. De andere bijwerkingen zijn:
- ernstige allergische reacties, zoals zwelling van gezicht, lippen, mond of tong en netelroos
- hoofdpijn
- diarree
- verwardheid/delirium/veranderde mentale status/desoriëntatie
- valt
ARIA is een veel voorkomende bijwerking die meestal geen symptomen veroorzaakt, maar wel ernstig kan zijn. Het wordt meestal gezien als een tijdelijke zwelling in de hersenen die meestal na verloop van tijd vanzelf verdwijnt. Tegelijkertijd verwijdert het verwijderen van amyloïd uit de hersenen ook amyloïd uit de bloedvaten, waardoor kleine bloedplekjes in of op het hersenoppervlak kunnen ontstaan.
ARIA werd waargenomen bij 41% van de deelnemers aan de klinische onderzoeken die aducanumab kregen, vergeleken met 10% van de deelnemers die een placebo kregen.
Hoewel de meeste mensen met een zwelling in hersengebieden geen symptomen hebben, kan ongeveer 30% van de mensen milde symptomen hebben, zoals:
- verwarring
- hoofdpijn
- duizeligheid
- zichtveranderingen
- misselijkheid
Daniel Gibbs, gepensioneerd neuroloog en langdurig deelnemer aan de klinische onderzoeken Aduhelm , deelde zijn ervaring met een uiterst zeldzame bijwerking van ARIA:
"Ik moet eerst zeggen, en dit is het dogma dat grotendeels waar is, dat [ARIA's] meestal goedaardig zijn. De meeste mensen weten niet dat ze het hebben. [ARIA's worden alleen ontdekt op MRI-scans waar kleine zwellingsgebieden of kleine gebieden met ijzerafzetting door bloedingen te zien zijn. Als mensen er symptomen van hebben, zijn die meestal mild. Hoofdpijn is de meest voorkomende, af en toe verwardheid.
Maar bijna altijd, zelfs bij symptomatische ARIA, gaan ze binnen een paar maanden weg als je stopt met het medicijn. Het medicijn kan weer veilig worden gestart. Er zijn heel weinig gevallen geweest, tenminste die zijn besproken door de maker van het medicijn Biogen, [van] catastrofale ARIA of ernstige ARIA, en de mijne behoorde tot die categorie. [...]
Ik begon meer hoofdpijn te krijgen. Ik heb niet zelden hoofdpijn, dus ik dacht er niet echt aan, maar ze werden wat frequenter en misschien wat ernstiger, maar nog steeds verlicht door receptvrije [medicijnen]. [...]
Een nacht of twee voor Kerstmis 2017 had ik de ergste hoofdpijn van mijn leven, het soort dat wij als neurologen associëren met een subarachnoïdale bloeding, een enorme bloeding in de hersenen. Ik nam mijn bloeddruk op en die was torenhoog en bleef hoog, dus ik dacht dat ik een beroerte had.
Ik liet me door mijn vrouw naar de eerste hulp brengen en tegen de tijd dat ik in ons plaatselijke ziekenhuis aankwam, kon ik echt geen samenhangende geschiedenis meer geven. [...]
Maar binnen een paar dagen ging het al iets beter. Mijn hoofdpijn ging weg, maar ik had nog steeds moeite met lezen. In de loop van de volgende maand werd het een beetje erger. Mijn MRI-scans toonden toen aan dat dit ARIA was met zowel de zwelling als de bloeding in mijn hersenen. Omdat het toenam, vond men dat het behandeld moest worden. Ik kreeg vijf doses hoge dosis steroïden en dat verlichtte de hoofdpijn en verwarring onmiddellijk. Maar het duurde ongeveer zes maanden voordat de zwelling in mijn hersenen helemaal weg was."
In het licht van deze zeldzame maar ernstige mogelijke bijwerkingen moeten de zorgverleners van patiënten MRI-scans (Magnetic Resonance Imaging) uitvoeren voor en tijdens de behandeling met Aduhelm om te controleren op ARIA.
Goedkeuring van Aduhelm (aducanumab)
Op 7 juni 2021 verleende de FDA versnelde goedkeuring aan Aduhelm (aducanumab) voor de behandeling van de ziekte van Alzheimer.
Versnelde goedkeuring is een type goedkeuring dat kan worden verleend aan geneesmiddelen die een positief therapeutisch effect laten zien in klinische onderzoeken, voordat al het sluitende bewijs is ingediend. Dit kan alleen worden toegepast op geneesmiddelen voor ernstige aandoeningen die een onvervulde medische behoefte vervullen; het laatste geneesmiddel dat werd goedgekeurd voor de behandeling van de ziekte van Alzheimer werd meer dan 18 jaar geleden goedgekeurd.
Versnelde goedkeuring wordt voorwaardelijk verleend. De FDA eist dat de fabrikant, Biogen, een nieuw klinisch onderzoek uitvoert om het klinische voordeel van het geneesmiddel te verifiëren Als het onderzoek geen voordelen aantoont, kan de FDA de goedkeuring van het geneesmiddel intrekken. Biogen heeft tot 2029 de tijd om nog een klinische studie uit te voeren om de voordelen van aducanumab voor Alzheimerpatiënten te bevestigen; experts stellen dat een derde klinische studie, die in twee jaar voltooid kan worden, een betere optie zou zijn geweest dan acht jaar wachten om erachter te komen of het medicijn werkt, terwijl patiënten de dure behandeling ondergaan en er het beste van hopen.
Een medische controverse met financiële ondertonen
De beslissing van de FDA om aducanumab goed te keuren heeft experts verbaasd die zeggen dat er niet genoeg bewijs is dat Aduhelm een effectieve behandeling is voor de ziekte van Alzheimer. Velen van hen, waaronder een onafhankelijk panel, adviseerden de FDA dat het beschikbare bewijs significante twijfels opriep dat aducanumab de cognitieve achteruitgang zou kunnen vertragen en debatteerden over de vraag of positieve resultaten van slechts één van de twee fase 3-studies voldoende basis is voor goedkeuring door de FDA.
Kort na de goedkeuring namen drie wetenschappers uit protest ontslag uit de onafhankelijke commissie die de FDA adviseerde over de behandeling, vanwege het gebrek aan overtuigend bewijs. Ze bekritiseerden ook de beslissing van de FDA om aducanumab goed te keuren voor iedereen met Alzheimer, ondanks het feit dat het onderzoek werd uitgevoerd bij Alzheimer in een vroeg stadium, en de acceptatie van de theorie dat het verminderen van amyloïde plaque de cognitieve symptomen daadwerkelijk zou vertragen (ondanks de onenigheid in de wetenschappelijke gemeenschap over de geldigheid ervan).
De beslissing van de FDA om aducanumab onder deze voorwaarden goed te keuren zou verschillende gevolgen kunnen hebben.
- Andere medicijnen die zich richten op amyloïde plaques, zoals donanemab van Eli Lilly, zouden sneller goedgekeurd kunnen worden dan eerder werd voorspeld, wat de interesse van farmaceutische bedrijven aanwakkert om te investeren in medicijnen tegen Alzheimer of hun betrokkenheid bij bestaande proeven voort te zetten.
- De beslissing van de FDA heeft een perceptie van flexibiliteit in de regelgeving gecreëerd die andere biotechbedrijven zou kunnen stimuleren om medicijnen te ontwikkelen voor zeldzame aandoeningen, een drang die is weggeëbd na een lange reeks mislukkingen in klinische onderzoeken, vooral in de 18 jaar tussen goedkeuringen van Alzheimerbehandelingen.
- Het medicijn is met $ 56.000 per jaar behoorlijk duur, wat betekent dat de tarieven van particuliere ziektekostenverzekeringen zouden kunnen stijgen omdat verzekeraars geacht worden ervoor te betalen, en het zal de belastingbetaler als onderdeel van Medicare (de Amerikaanse nationale ziektekostenverzekering) zwaarder belasten. Sommigen zeggen dat het "verwoestend" zou kunnen zijn voor Medicare, niet alleen vanwege de basiskosten, maar ook omdat de behandeling met Aduhelm vereist dat patiënten eerdere diagnoses krijgen met ruggenmergtaps om amyloïd op te sporen en constante monitoring met MRI's (onder andere), wat de kosten aanzienlijk verhoogt en de medische systemen onder druk zet.
De goedkeuring wordt ook gezien als een meevaller voor Biogen, want hun aandelen stegen met meer dan 50%, terwijl de aandelen van de Japanse partner Eisai Co met 56% stegen. Analisten voorspellen dat Aduhelm in potentie zo'n $10 miljard aan omzet kan opleveren, gezien het feit dat er alleen al in de VS 6 miljoen mensen zijn met de ziekte van Alzheimer. Het medicijn is belangrijk voor de groei van Biogen omdat de concurrentie de verkoop van hun medicijnen - Tecfidera voor multiple sclerose (MS) en Spinraza voor spinale musculaire atrofie (SMA) - heeft geschaad.
Spinraza is een ander geneesmiddel in Biogen's portfolio met een hoog prijskaartje, met een catalogusprijs van $750.000 voor het eerste jaar van behandeling en $375.000 per jaar daarna.
Niet iedereen is kritisch over de beslissing van de FDA om Aduhelm goed te keuren
Omdat Alzheimer een progressieve ziekte is, hebben patiënten eerder een behandeling nodig dan later. Het nieuws van de beslissing van de FDA heeft velen nieuwe hoop gegeven, ofwel dat de behandeling werkt voor henzelf of hun dierbare, ofwel dat het andere bedrijven zal aanzetten tot actie om andere behandelingen voor Alzheimer te ontwikkelen.
Belangengroepen van patiënten hadden krachtig aangedrongen op goedkeuring omdat er slechts zes andere behandelingen beschikbaar zijn voor de slopende ziekte, die de symptomen slechts enkele maanden bestrijden. In november 2020 stemde het adviescomité van de FDA tegen de goedkeuring van Aduhelm, wat leidde tot woede en vervolgens tot actie bij de Alzheimer's Association, die vervolgens campagne voerde om hun steun te betuigen voor het potentieel van het medicijn en om de noodzaak van hoop en vooruitgang te benadrukken.
In januari 2021 kwamen de FDA en patiëntengroepen bijeen in een luistersessie waar patiënten, zorgverleners, clinici en pleitbezorgers vóór de behandeling waren, onder andere met het argument dat patiënten het zich niet kunnen veroorloven om nog langer op een behandeling te wachten.
FDA Office of New Drugs Director Peter Stein bevestigde tijdens een persconferentie dat de mening van patiënten een rol speelde. Hij zei dat de FDA "heel duidelijk van patiënten heeft gehoord dat ze bereid zijn om enige onzekerheid te accepteren om toegang te krijgen tot een medicijn dat zinvol voordeel kan bieden bij het voorkomen van de progressie van deze ziekte, die, zoals we allemaal weten, zeer verwoestende gevolgen kan hebben."
Patrizia Cavazzoni, de waarnemend directeur van het FDA's Center for Drug Evaluation and Research, zei tijdens dezelfde persconferentie dat "de gegevens ondersteunen dat patiënten en zorgverleners de keuze hebben om dit medicijn te gebruiken".
"Deze goedkeuring door de FDA luidt een nieuw tijdperk in voor de behandeling van en het onderzoek naar Alzheimer", zegt Maria Carrillo, Ph.D., chief science officer van de Alzheimer's Association. "De geschiedenis heeft ons geleerd dat goedkeuring van het eerste medicijn in een nieuwe categorie het veld stimuleert, investeringen in nieuwe behandelingen verhoogt en meer innovatie aanmoedigt."
Wanneer wordt Aduhelm goedgekeurd in Europa?
De ziekte van Alzheimer groeit snel uit tot een van de grootste medische, economische en sociale crises van deze eeuw - en een die moeilijk in een vroeg stadium op te sporen is, vooral gezien het gebrek aan specialisten in Europa die een diagnose kunnen bevestigen. In 2018 leden alleen al in Europa 9,7 miljoen mensen aan de ziekte van Alzheimer en andere vormen van dementie; tegen 2030 zal het aantal patiënten naar verwachting stijgen tot 14 miljoen, waardoor er een grote behoefte ontstaat aan effectieve behandelingen.
Aduhelm is nog niet goedgekeurd buiten de Verenigde Staten. Biogen heeft een aanvraag ingediend voor wettelijke beoordeling in de Europese Unie in oktober 2020, evenals in Japan, Canada, Australië en Brazilië aan het einde van het jaar 2020.
Volgens het Europees Geneesmiddelenbureau (EMA) neemt de beoordeling van een aanvraag voor een vergunning voor het in de handel brengen van een nieuw geneesmiddel gewoonlijk ongeveer een jaar in beslag, minder als de ontwikkelaar van het geneesmiddel een versnelde beoordeling krijgt.
In maart van dit jaar ontving Biogen's productiefaciliteit van $ 2 miljard in Zwitserland een Good Manufacturing Practice (GMP) licentie van het Zwitserse Agentschap voor Therapeutische Producten (Swissmedic). Biogen is van plan om eind 2021 FDA-goedkeuring aan te vragen voor de productie van Aduhelm in de Zwitserse faciliteit en verwacht het geneesmiddel aan meer dan 1 miljoen patiënten per jaar te kunnen leveren.
Toegang tot Aduhelm buiten de Verenigde Staten
Aduhelm is op dit moment goedgekeurd door de FDA en beschikbaar voor inwoners van de Verenigde Staten - en er zijn regels die het mogelijk maken om medicijnen te importeren in landen waar ze op dit moment nog niet zijn goedgekeurd.
Patiënten met levensbedreigende of slopende ziekten hebben recht op toegang tot, aankoop en invoer van medicijnen met de hulp van hun behandelende artsen.
Patiënten en hun artsen kunnen dit doen op basis van de compassionate use of named patient import regulations, een wettelijke uitzondering op de algemene regel dat een geneesmiddel normaal gesproken alleen toegankelijk is na markttoelating/goedkeuring (welke formulering we ook gebruiken) in het land waar de patiënt woont. Dankzij deze uitzondering kunnen patiënten op een legale, ethische en veilige manier toegang krijgen tot geneesmiddelen die in hun land nog niet zijn goedgekeurd.
Lees hier meer over de "named patient basis" (EMA).
everyone.org streeft ernaar dat patiënten en hun behandelende artsen toegang hebben tot alle medicijnen die wereldwijd beschikbaar zijn voor de best mogelijke behandeling. We werken 100% conform de regelgeving in uw land als u zich buiten de Verenigde Staten bevindt. Als je meer details wilt lezen, toegang wilt krijgen tot het medicijn of contact wilt opnemen met ons ondersteuningsteam , kun je dat hier doen.
Hoeveel kost Aduhelm ?
Biogen heeft aangekondigd dat de kosten van Aduhelm in de onderhoudsdosis (10 mg/kg) voor een gemiddelde patiënt $ 56.000 per jaar zouden bedragen. Dat is exclusief de testen die patiënten voorafgaand aan de behandeling en tijdens de behandeling moeten doen.
Biogen heeft kritiek gekregen op de hoge prijs van het medicijn per jaar.
Het non-profit Institute for Clinical and Economic Review (ICER), dat de prijzen van medicijnen analyseert, gaf aan dat een eerlijke jaarlijkse prijs zou variëren van $2.500 tot $8.300 per patiënt per jaar. In een verklaring zei ICER dat de goedkeuring van de FDA patiënten niet heeft beschermd en dat Biogen meer dan $50 miljard per jaar zou kunnen opstrijken "zelfs terwijl er wordt gewacht op bewijs dat bevestigt dat patiënten daadwerkelijk baat hebben bij de behandeling".
Biogen CEO Michel Vounatsos heeft op de kritiek gereageerd door te beweren dat de prijs van het medicijn gerechtvaardigd wordt door de waarde die het zal opleveren voor patiënten en een maatschappij die minder belast wordt door Alzheimer, en dat de prijs een weerspiegeling is van "twee decennia geen innovatie". "Het is tijd om te investeren in behandeling", voegde hij eraan toe.
Bij everyone.org kunnen we de prijs die Biogen bepaalt niet beïnvloeden. We kunnen patiënten helpen toegang te krijgen tot Aduhelm tegen de volgende prijzen:
- €1.958,58 voor één injectieflacon van 170 mg/1,7 ml (100 mg/mL)
- €3.046,68 voor één injectieflacon van 300 mg/3 ml (100 mg/mL)
Doe hier een aanvraag voor meer informatie.
Aankomende behandelingen voor de ziekte van Alzheimer
Uit een onderzoek dat in mei 2021 werd gepubliceerd, blijkt dat er momenteel 126 behandelingenvoor de ziekte van Alzheimer in klinisch onderzoekzijn. 82,5% daarvan is gericht op modificatie van de ziekte, 10,3% verbetert de cognitie en 7,1% richt zich op het verlichten van neuropsychiatrische symptomen.
- Fase 3-onderzoeken: 28 behandelingen (inclusief aducanumab)
- Fase 2-onderzoeken: 74 behandelingen
- Fase 1-onderzoeken: 24 behandelingen
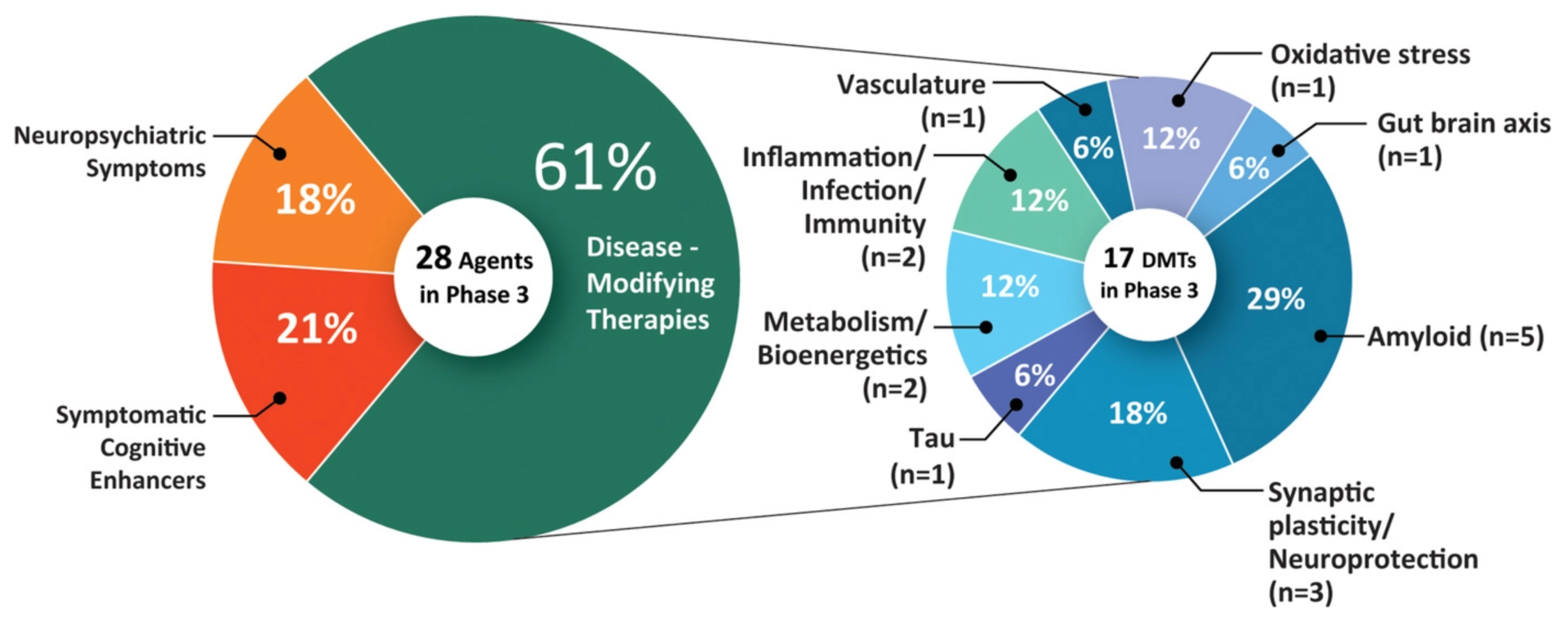
De behandelingen in Fase 3 zullen hoogstwaarschijnlijk in het komende jaar worden goedgekeurd.
Lecanemab
Het monoklonale antilichaam lecanemab, dat op een vergelijkbare manier werkt als aducanumab (het immuunsysteem aanzetten tot het verwijderen van bèta-amyloïde plaques), is volgens de gepubliceerde rapporten veelbelovend en bevindt zich nu in Fase 3 van het klinisch onderzoek.
Gantenerumab
Gantenerumab bindt aan beta-amyloïd, in het bijzonder aan plaques van beta-amyloïd in vergelijking met individueel beta-amyloïd dat in het bloed circuleert. Men denkt dat het amyloïde plaques oplost en beta-amyloïde verwijdert door fagocytose te stimuleren, een proces waarbij een cel een bepaald molecuul in zich opneemt en verteert. Eerdere klinische studies met gantenerumab toonden aan dat het de beta-amyloïde plaque verminderde bij mensen met de meer voorkomende vorm van Alzheimer die niet direct wordt veroorzaakt door genmutaties. Het wordt nog steeds onderzocht in twee grote wereldwijde fase III-studies.
Solanezumab
Solanezumab is een antilichaam dat bedoeld is om bèta-amyloïde "op te ruimen" uit het bloed en de hersenvloeistof, waardoor plaquevorming wordt voorkomen. Er werden voordelen gerapporteerd bij deelnemers die deelnamen aan de volledige periode van drie en een half jaar van de onderzoeken, en minder bij deelnemers die later deelnamen, dus er is nog meer te leren over de effecten.
Donanemab
Donanemab lijkt een ander veelbelovend nieuw medicijn te zijn voor de behandeling van Alzheimer. Het wordt getest door Eli Lilly and Company, dat van plan is 1500 deelnemers in te schrijven voor een groot onderzoek om de resultaten van het kleinere onderzoek te bevestigen; dit eerdere onderzoek duurde 76 weken en omvatte 257 patiënten en toonde volgens de rapporten aan dat donanemab de voortgang van de ziekte van Alzheimer aanzienlijk vertraagde.
Anderen
Saracatinib is een experimentele verbinding die werkt als een remmer van een eiwit genaamd Fyn kinase dat helpt bij de vorming van beta-amyloïde plaques. Een onderzoek bij muizen toonde aan dat saracatinib, door het remmen van Fyn kinase, effectief was in het omkeren van geheugenverlies bij muizen. Remming van Fyn kinase kan de progressie van de ziekte voorkomen of vertragen.
Onderzoekers van het Salk Institute for Biological Studies in Californië bestuderen een chemische stof genaamd fisetin en ontwikkelden een versie van fisetin genaamd CMS121, waarvan ze ontdekten dat het effectief is bij het vertragen van het verlies van hersencellen. Er is meer onderzoek nodig voordat een medicijn kan worden goedgekeurd.
Over de recente goedkeuring van Aduhelmzei Maria Carrillo, Chief Science Officer van de patiëntenvereniging Alzheimer's Association in Chicago, VS, in een verklaring voor Nature: "We zijn hoopvol, en dit is het begin - zowel voor dit medicijn als voor betere behandelingen voor Alzheimer."
"Alles wat we echt zijn, zijn onze gedachten en onze hersenen." - Sandy, voormalig tandarts en assistent-professor en Alzheimerpatiënt.
Bij everyone.org zijn we ervan overtuigd dat wetenschap de mensheid vooruit helpt en levens verbetert of zelfs redt. De ziekte van Alzheimer brengt de levenskwaliteit van velen in gevaar. We moedigen wetenschappers die zich inzetten om een (deel van de) oplossing te vinden aan om door te zetten en we kijken ernaar uit dat behandelingen in ontwikkeling met veelbelovende resultaten binnen de komende 3 jaar worden goedgekeurd en toegankelijk worden voor Alzheimerpatiënten over de hele wereld.




