Wat is het verschil tussen Leqembi en Aduhelm? Een eenvoudig overzicht.
Laatst bijgewerkt: 19 november 2024
U kunt legaal toegang krijgen tot nieuwe geneesmiddelen, zelfs als ze niet zijn goedgekeurd in uw land.
Leer hoeSinds 2021 heeft de FDA twee nieuwe geneesmiddelen tegen Alzheimer versneld goedgekeurd. Deze geneesmiddelen zijn de anti-amyloïde therapieën Leqembi (lecanemab) en Aduhelm (aducanumab). Beide goedkeuringen kwamen na bijna 20 jaar zonder grote doorbraken in de behandeling van Alzheimer. Hierdoor hebben beide medicijnen veel media-aandacht gekregen.
De reacties waren echter gemengd. Maria Carrillo, de Chief Science Officer van de Alzheimer's Association, noemde de goedkeuringen van de nieuwe medicijnen "een mijlpaal voor mensen die in aanmerking komen voor deze behandeling" [2]. Tegelijkertijd is het goedkeuringsproces omgeven door controverse, vooral in het geval van Aduhelm[1, 4].
Als patiënt vraag je je waarschijnlijk af wat het verschil is tussen Leqembi (lecanemab) en Aduhelm (aducanumab). In dit artikel vergelijken we de twee medicijnen op hun werking, werkzaamheid, kosten en beschikbaarheid.
Leqembi vs Aduhelm: Waar worden ze voor gebruikt?
Beide medicijnen zijn behandelingen voor de vroege ziekte van Alzheimer. Het zijn anti-amyloïde therapieën die zich richten op amyloïde plaques in de hersenen.
Volgens hun voorschriftinformatie zijn Leqembi en Aduhelm bedoeld voor patiënten met milde cognitieve stoornissen en met bevestigde verhoogde bèta-amyloïdspiegels [5].
Leqembi vs Aduhelm: Hoe werken ze?
Gelijkenissen
Leqembi (lecanemab) en Aduhelm (aducanumab) zijn beide monoklonale antilichamen. Ze zijn ontworpen om de beta-amyloïde plaques aan te pakken die zich ophopen in de hersenen van Alzheimerpatiënten. Aangenomen wordt dat deze plaques bijdragen aan de cognitieve achteruitgang en klinische achteruitgang die bij deze ziekte worden gezien.
Beide medicijnen binden zich aan amyloïde plaques en neutraliseren deze, met als doel de progressie van de ziekte te vertragen. Dit is wat Leqembi en Aduhelm fundamenteel anders maakt dan eerdere behandelingen tegen Alzheimer, zoals galantamine, rivastigmine en donepezil. Deze eerdere behandelingen richten zich op het verlichten van de symptomen van de ziekte. Leqembi en Aduhelm willen het verloop van de ziekte veranderen door de onderliggende oorzaak aan te pakken.
Verschillen
Leqembi en Aduhelm binden aan verschillende delen van het beta-amyloïde eiwit. Aduhelm bindt sterker aan grotere, verharde amyloïde plaques. Leqembi zou zich beter richten op de kleinere, oplosbare (en meer toxische) vorm van amyloïde eiwit [6].
Hoe efficiënt zijn Leqembi en Aduhelm?
De werkzaamheid van Leqembi(lecanemab) en Aduhelm(aducanumab) is onderzocht in klinische studies.
-
Resultaten klinisch onderzoek Leqembi
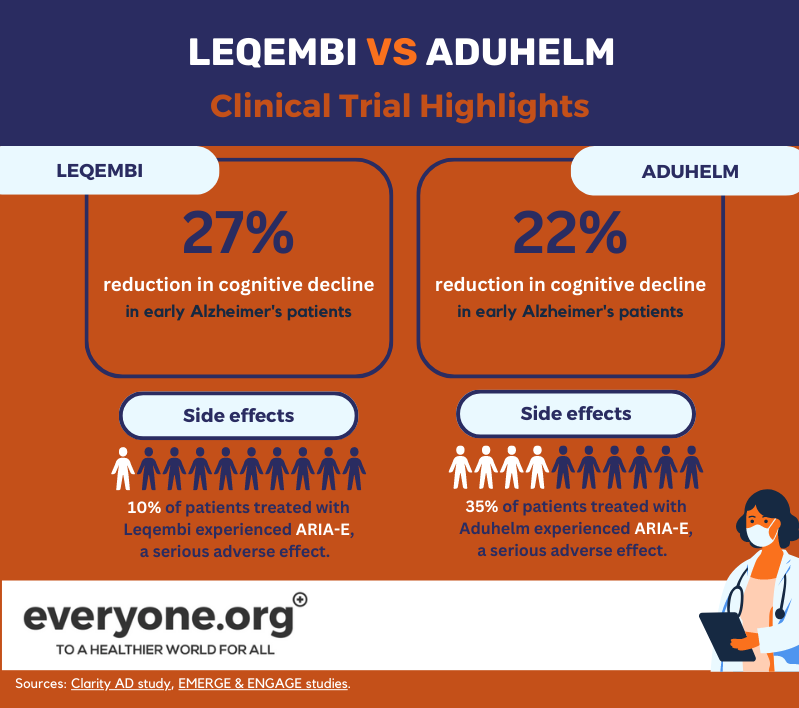
De versnelde goedkeuring van Leqembi door de FDA was gebaseerd op de positieve resultaten van de Fase 3-studie Clarity AD. Volgens deze resultaten vertraagde Lecanemab de cognitieve achteruitgang tot 27% bij vroege patiënten met Alzheimer, vergeleken met placebo. Deze resultaten werden gemeten 18 maanden na aanvang van de behandeling [8].
Een aanvullende analyse van de onderzoeksresultaten werd gepubliceerd in april 2023. Hieruit bleek dat zelfs nadat patiënten gedurende een periode van 9 tot 59 maanden waren gestopt met het innemen van Leqembi, ze nog steeds voordeel hadden van een vertraging van de cognitieve achteruitgang. Tijdens deze "tussenperiode" leek de ziekte van Alzheimer zich consequent langzamer te ontwikkelen bij patiënten die Leqembi kregen in de oorspronkelijke klinische studie, in vergelijking met degenen die placebo kregen [7].
De ernstige bijwerking van ARIA-E trad op bij 10% van de patiënten die met Leqembi werden behandeld. 6% van de patiënten in het onderzoek kreeg te maken met ARIA-H, een andere ernstige bijwerking [13].
-
Aduhelm resultaten klinisch onderzoek
De FDA verleende haar versnelde goedkeuring aan Aduhelm op basis van twee klinische fase 3-onderzoeken. Eén daarvan (EMERGE) toonde een vermindering van de klinische achteruitgang van patiënten tot 22% [12]. De andere (ENGAGE) niet. In beide onderzoeken toonde Aduhelm echter een vermindering van amyloïde plaques in de hersenen [9]. De FDA besloot dat het "redelijkerwijs waarschijnlijk is dat deze indicatie zal resulteren in [een] klinisch voordeel" [ 10].
Een Fase 4 bevestigende studie (ENVISION) startte in juni 2022, overeenkomstig het verzoek van de FDA. De resultaten worden verwacht in 2026 [9].
Volgens de voorschrijfinformatie van Aduhelm ondervond 35% van de patiënten die het geneesmiddel in klinische onderzoeken kregen ARIA-E. 34% van de patiënten die het geneesmiddel in onderzoeken kregen, ondervond ARIA-H [15]. 34% van de proefpatiënten ervoer ARIA-H [15].
Zoals deze huidige gegevens laten zien, lijkt het belangrijkste verschil tussen Leqembi en Aduhelm op dit moment te zitten in hun veiligheidsprofiel, waarbij Leqembi een lagere incidentie van bijwerkingen laat zien.
Tegelijkertijd lijkt Leqembi op basis van de huidige klinische onderzoeksgegevens een consistenter effect te hebben op cognitieve achteruitgang. De resultaten van lopende onderzoeken naar zowel Leqembi als Aduhelm zullen meer duidelijkheid verschaffen over de prestaties van beide geneesmiddelen.
OPMERKING: De resultaten die hier worden gedeeld zijn ter informatie en mogen niet worden gebruikt als basis voor een keuze van behandeling. Uw arts is het beste in staat om te bepalen welke behandeling het beste op uw geval van toepassing is.

Leqembi vs Aduhelm: Veiligheid en bijwerkingen
Volgens de bijsluiter zijn dit de meest voorkomende bijwerkingen van Leqembi (lecanemab) en Aduhelm:
Leqembi bijwerkingen
- infusiegerelateerde reacties, waaronder koorts, griepachtige symptomen, misselijkheid, veranderingen in de hartslag en kortademigheid;
- hoofdpijn;
- Amyloïd-gerelateerde beeldafwijkingen (ARIA) [13]. Bij ARIA kan er sprake zijn van tijdelijke zwelling of bloeding in de hersenen. Symptomen van ARIA zijn hoofdpijn, verwardheid, aanvallen, moeite met lopen en duizeligheid. Dragers van het homozygote apolipoproteïne E-gen lopen mogelijk een hoger risico op ARIA [14].
Aduhelm bijwerkingen
De meest voorkomende bijwerkingen van Aduhelm zijn ARIA, hoofdpijn en vallen. Een bijwerking die is vermeld voor Aduhelm maar niet voor Leqembi is overgevoeligheid. Overgevoeligheidsreacties kunnen angio-oedeem (zwelling van de diepere huidlagen) en urticaria (huiduitslag) zijn [15].
Leqembi vs Aduhelm: Prijsvergelijking
Als het gaat om medicijnen die nog niet overal verkrijgbaar zijn, moet je elke prijs slechts als een indicatie beschouwen. De uiteindelijke kosten kunnen variëren afhankelijk van je locatie, leveranciers of verzekeringsdekking.
Om je een idee te geven: een flacon Leqembi met één dosis kost ongeveer EUR 1.043. Met de aanbevolen tweewekelijkse toediening van het geneesmiddel brengt dit de jaarlijkse kosten voor 1 persoon op ongeveer EUR 27.118 [16].
De indicatieve prijs van Aduhelm per doseerflacon is EUR 1.335. In termen van jaarlijkse kosten voor 1 persoon komt dit neer op EUR 34.710 [17].
Waar zijn Leqembi en Aduhelm goedgekeurd?
Leqembi (lecanemab) is momenteel alleen goedgekeurd in de Verenigde Staten en het Verenigd Koninkrijk, en de goedkeuring van de EMA wordt verwacht tegen het einde van 2024[3]. Leqembi heeft ook aanvragen ingediend voor een vergunning voor het in de handel brengen in China en Japan [18, 19, 20].
Aduhelm (aducanumab) kreeg in juni 2021 versnelde goedkeuring van de FDA in de VS. Het Europees Geneesmiddelenbureau (EMA) verwierp Aduhelm's marketingaanvraag in december 2021. De aanvraag werd vervolgens in april 2022 door Biogen ingetrokken [21]. Het Japanse ministerie van Volksgezondheid heeft ook een negatief signaal afgegeven over Aduhelm's goedkeuring in het land [22].
Is Leqembi of Aduhelm (nog) niet goedgekeurd of beschikbaar in jouw land? Als jij en je arts van mening zijn dat je baat zou kunnen hebben bij deze behandelingen, neem dan contact op met ons team van medische toegangsexperts. We kunnen je een gepersonaliseerde prijsofferte geven om het geneesmiddel voor jou te sourcen.
Referenties:
- Het anti-amyloïde monoklonale antilichaam Lecanemab: 16 waarschuwende opmerkingen. Zenodo, 3 januari 2023.
- Hamilton, Jon. FDA geeft Alzheimer-medicijn Leqembi versnelde goedkeuring : Shots - Health News. NPR, 6 januari 2023.
- FDA Advisory Committee stemt unaniem voor de bevestiging van het klinische voordeel van LEQEMBI® (lecanemab-irmb) voor de behandeling van de ziekte van Alzheimer. Biogen Investor Relations, 9 juni 2023.
- Helmore, Edward. FDA onder vuur over goedkeuring van Alzheimermedicijn Aduhelm. The Guardian, 29 december 2022.
- HOOGTEPUNTEN VAN DE VOORSCHRIJFINFORMATIE. Leqembi, geraadpleegd op 3 augustus 2023.
- Taylor, Emma. Nieuwe behandeling voor Alzheimer, lecanemab, haalt de krantenkoppen: wat nu? Alzheimer's Research UK, 13 december 2022.
- Eisai: Alzheimerpatiënten zien voordelen van Leqembi, zelfs als het wordt gestopt. CNBC, 6 april 2023.
- Leqembi | ALZFORUM. Alzforum, 30 mei 2023, geraadpleegd op 3 augustus 2023.
- Aduhelm |ALZFORUM. Alzforum, 6 februari 2023, geraadpleegd op 3 augustus 2023.
- Cavazzoni, Patrizia. Besluit van de FDA om een nieuwe behandeling voor de ziekte van Alzheimer goed te keuren. FDA, 7 juni 2021.
- Eisai presenteert volledige resultaten van de Clarity AD Fase III studie met lecanemab. Alzheimer Europe, 30 november 2022.
- Resultaten EMERGE en ENGAGE: Twee Fase 3-studies om Aducanumab te evalueren bij patiënten met de vroege ziekte van Alzheimer. Biogen Investor Relations, geraadpleegd op 3 augustus 2023.
- Referentie ID: 5105416. Accessdata.fda.gov, geraadpleegd op 3 augustus 2023.
- MEDICATIEGIDS LEQEMBI® (leh-kem'-bee) (lecanemab-irmb) injectie, voor intraveneus gebruik. Leqembi, geraadpleegd op 3 augustus 2023.
- HOOGTEPUNTEN VAN DE VOORSCHRIJFINFORMATIE. Accessdata.fda.gov, geraadpleegd op 3 augustus 2023.
- Leqembi (lecanemab-irmb) online kopen - prijs & kosten. Everyone.org, Geraadpleegd op 3 augustus 2023.
- Koop Aduhelm (aducanumab-avwa) Online - Prijs & Kosten. Everyone.org, Geraadpleegd op 3 augustus 2023.
- EISAI BEVAT MARKETING AUTHORIZATION APPLICATION FOR LECANEMAB AS TREATMENT FOR EARLY ALZHEIMER'S DISEASE IN EUROPE | Biogen. Biogen | Investeerdersrelaties, 10 januari 2023.
- Eisai start BLA indiening van gegevens voor Lecanemab in China | Biogen. Biogen | Investeerdersrelaties, 22 december 2022.
- Carvalho, Teresa, en Ray Burow. Lecanemab, for Early Alzheimer's Coming Up for Review in Japan. Alzheimer's News Today, 14 maart 2022.
- Update over registratie van Aducanumab in de Europese Unie | Biogen. Biogen | Investeerdersrelaties, 22 april 2022.
- Swift, Rocky, et al. Eisai-Biogen Alzheimermedicijn moeilijk te beoordelen-Japans ministerie. Reuters, 22 december 2021.