Nieuwe behandelingen voor Neurofibromatose: Wat is er beschikbaar en hoe krijg ik er toegang toe in het Verenigd Koninkrijk?
Laatst bijgewerkt: 11 maart 2025
U kunt legaal toegang krijgen tot nieuwe geneesmiddelen, zelfs als ze niet zijn goedgekeurd in uw land.
Leer hoeNeurofibromatose type 1 (NF1) is een complexe genetische aandoening die wereldwijd bij ongeveer één op de 3.000 mensen voorkomt. In het Verenigd Koninkrijk leven ongeveer 25.000 mensen met de aandoening.
NF1 leidt vaak tot de ontwikkeling van plexiforme neurofibromen (pNF's) - tumoren die pijn, misvormingen en ernstige complicaties kunnen veroorzaken. Tot voor kort waren de behandelingsmogelijkheden beperkt tot chirurgie en symptoombestrijding.
De laatste jaren bieden nieuwe doelgerichte therapieën een betere controle over de ziekte en een betere kwaliteit van leven. De eerste innovatie kwam met Koselugo (selumetinib), de eerste door de FDA goedgekeurde MEK-remmer voor NF1-gerelateerde pNFs. In februari 2025 keurde de FDA ook Gomekli (mirdametinib) goed, waarmee een andere belangrijke mijlpaal in de behandeling van NF1 werd bereikt.
Als je in het Verenigd Koninkrijk woont en je je afvraagt wanneer en hoe je toegang kunt krijgen tot deze nieuwe behandelingen voor NF1, dan is dit wat je moet weten.
Wat zijn de nieuwste behandelingen voor NF1?
De twee meest recente NF1-medicijnen die door de FDA zijn goedgekeurd, zijn beide MEK-remmers. Dit betekent dat ze enzymen (MEK1/2) blokkeren die betrokken zijn bij de signalering van celgroei. MEK1/2 zijn overactief bij patiënten met NF1, wat bijdraagt aan de groei van tumorcellen. Door de MEK-enzymen te blokkeren willen deze nieuwe neurofibromatosebehandelingen de groei van tumorcellen afremmen 1.
Gomekli (mirdametinib): Het nieuwste NF1-medicijn in 2025
Gomekli (mirdametinib) is een MEK1/2-remmer die zich richt op de MAPK/ERK-signaleringsroute. Gomekli werd in februari 2025 goedgekeurd door de FDA en verschilt onder andere op de volgende manieren van bestaande behandelingen:
- Orale toediening. Gomekli kan met of zonder voedsel worden ingenomen en is verkrijgbaar in capsulevorm en in tabletvorm voor orale suspensie - dit is met name geschikt voor kinderen die geen capsule kunnen doorslikken.
- Goedgekeurd voor zowel volwassenen als kinderen. Gomekli is niet alleen geïndiceerd voor gebruik bij volwassen patiënten, maar ook bij kinderen vanaf 2 jaar.
- Goede werkzaamheid aangetoond in klinische onderzoeken. In het Fase 2 ReNeu-onderzoek toonde Gomekli positieve resultaten, waarbij 62% van de volwassenen en 52% van de kinderen een afname van >50% van de tumorgrootte 2 bereikten.
Koselugo selumetinib): Een MEK-remmer voor pediatrische NF1-patiënten
Koselugo was de eerste doelgerichte therapie die in 2020 werd goedgekeurd voor NF1. Tot nu toe is het alleen goedgekeurd voor kinderen van 2 jaar en ouder. Enkele recent gepubliceerde resultaten van de fase 3 KOMET-studie suggereren dat het ook een efficiënte behandelingsoptie kan zijn voor volwassenen met neurofibromatose type 1 en 3. Maar vanaf maart 2025 is het nog niet goedgekeurd voor die doelgroep. Vanaf maart 2025 is het echter nog niet goedgekeurd voor die doelgroep.
Sinds 2021 is selumetinib ook goedgekeurd voor gebruik in de EU, en sinds 2022 ook in het VK.
Hier is een snelle vergelijking van Gomekli en Koselugo:
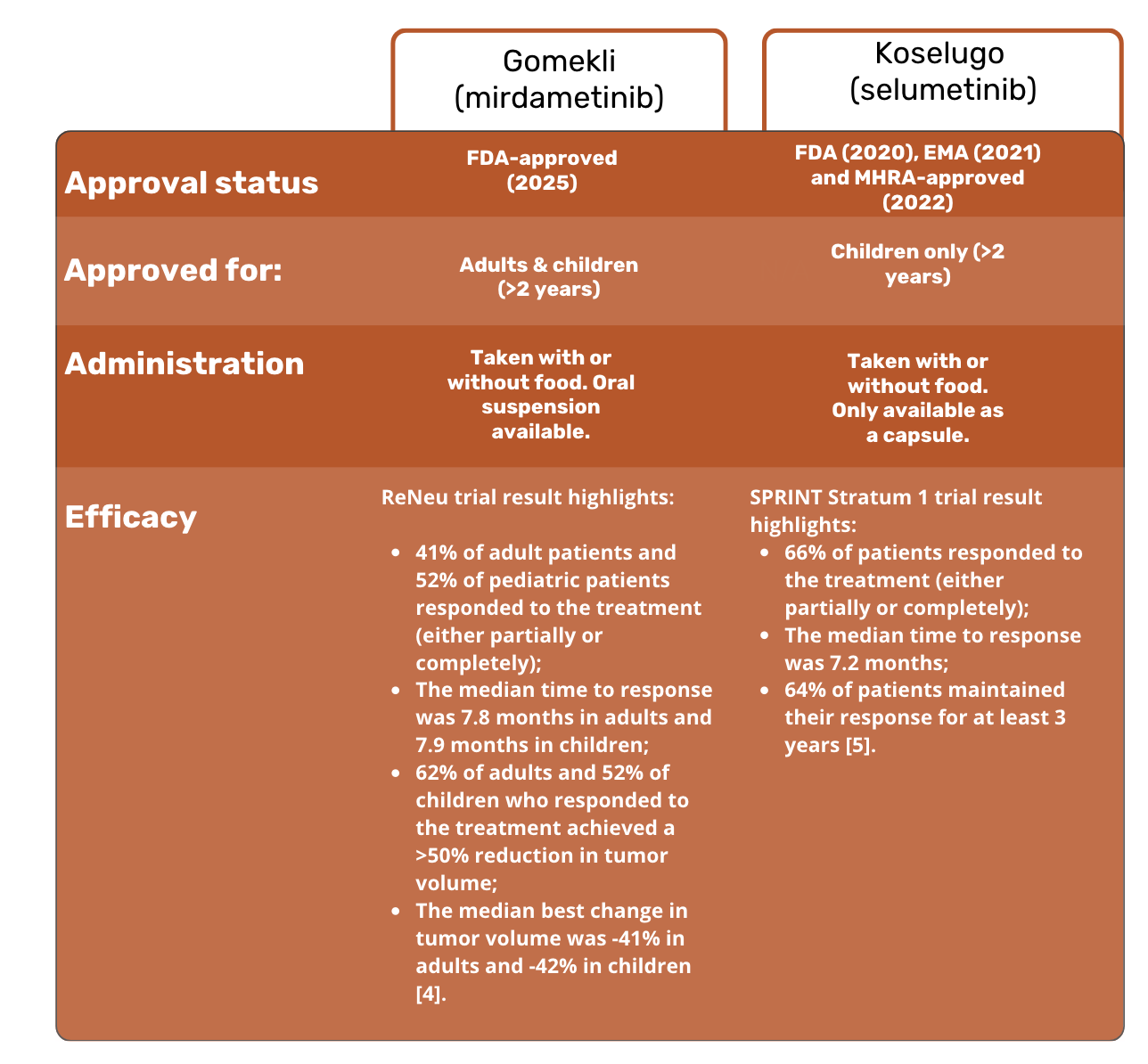

Zijn Gomekli en Koselugo verkrijgbaar in het Verenigd Koninkrijk?
Koselugo selumetinib) is beschikbaar voor patiënten in het Verenigd Koninkrijk en is opgenomen in de NHS 6.
Gomekli is daarentegen nog niet beschikbaar in het Verenigd Koninkrijk en is ook nog niet goedgekeurd of beschikbaar in de EU. Een typische goedkeuringsprocedure van de EMA duurt tot 210 dagen vanaf de indiening van de aanvraag en in het geval van Gomekli is er nog geen aanvraag ingediend. Dit betekent dat het nog jaren kan duren voordat NF1-patiënten in de EU en het VK toegang krijgen tot dit geneesmiddel.
Kun je Gomekli in het VK krijgen voordat het lokaal is goedgekeurd?
Ja, dat kan. Hoewel EMA en MHRA goedkeuringen voor mirdametinib niet bepaald om de hoek liggen, hebben patiënten in het Verenigd Koninkrijk (en elders) opties om toegang te krijgen tot Gomekli voordat het officieel beschikbaar komt. Eén manier is om deel te nemen aan een klinische studie. Een andere manier is om Gomekli uit het buitenland te halen, voor persoonlijk gebruik.
Hier wordt uitgelegd hoe elke optie werkt.
Doe mee aan een klinisch onderzoek
Om snel toegang te krijgen tot de nieuwste behandeling voor neurofibromatose, kun je proberen deel te nemen aan een lopend klinisch onderzoek. Hiervoor moet je voldoen aan de toelatingscriteria. Je hebt ook de steun van je behandelend arts nodig. Het is goed om in gedachten te houden dat een trial niet garandeert dat je in de behandelgroep terechtkomt. U kunt in plaats daarvan een placebo krijgen.
Hier zijn enkele goede plaatsen om te beginnen met het zoeken naar lopende klinische onderzoeken:
- ClinicalTrials.gov: Dit is een database met alle klinische onderzoeken in de VS. Sommige onderzoeken staan echter ook open voor internationale deelnemers. Op dit moment rekruteren deze mirdametinib trials patiënten wereldwijd. Het kan de moeite waard zijn om ze in de gaten te houden.
- EUClinicaltrials.eu: Deze database bevat alle klinische onderzoeken in de Europese Unie. Momenteel bevat deze beperkte informatie over onderzoeken die vóór 31 januari 2022 zijn gestart. Voor deze onderzoeken kunt u het EU Clinical Trials Register raadplegen.
- myTomorrows: Deze organisatie ondersteunt patiënten bij het vinden van behandelingsmogelijkheden in klinische onderzoeken.
- Findmecure: Een platform waarop patiënten wereldwijd klinische onderzoeken kunnen vinden en eraan kunnen deelnemen.
Krijg Gomekli voor persoonlijk gebruik
Als een klinische studie voor jou geen optie is, kun je Gomekli misschien uit het buitenland importeren voor persoonlijk gebruik. Dit is toegestaan onder de Named Patient Import regeling.
Hoe het werkt:
- Als Gomekli in een ander land (bijv. de VS) eerder is goedgekeurd dan in Groot-Brittannië, kun je het legaal kopen en importeren.
- Je hebt een recept van je arts nodig dat bevestigt dat er lokaal geen geschikte alternatieven beschikbaar zijn.
Hulp nodig? Ons deskundige Medicijntoegangsteam bij Everyone.org is gespecialiseerd in het helpen van patiënten om toegang te krijgen tot nieuwe medicijnen voordat ze lokaal zijn goedgekeurd. Neem contact met ons op en we helpen je graag om toegang te krijgen tot Gomekli in Groot-Brittannië.
Referenties:
- Koselugo | Europees Geneesmiddelenbureau (EMA). Europees Geneesmiddelenbureau, geraadpleegd op 11 maart 2025.
- Mirdametinib scoort FDA Priority Review voor Neurofibromatose Type 1 met PN. Targeted Oncology, 28 augustus 2024.
- Koselugo toonde statistisch significante en klinisch betekenisvolle objectieve respons versus placebo bij volwassenen met neurofibromatose type 1 in wereldwijde KOMET Fase III studie. AstraZeneca, 12 november 2024.
- SpringWorks Therapeutics kondigt gegevens aan die zullen worden gepresenteerd op de jaarlijkse bijeenkomst van de American Society of Clinical Oncology (ASCO) in 2024. SpringWorks Therapeutics, 23 mei 2024.
- Koselugo® (selumetinib) | Werkzaamheid. Koselugo HCP, geraadpleegd op 11 maart 2025.
- Selumetinib voor de behandeling van symptomatische en inoperabele plexiforme neurofibromen geassocieerd met type 1 neurofibromatose bij kinderen vanaf 3 jaar. NICE, geraadpleegd op 11 maart 2025.