Enhertu voor longkanker: Waar is het goedgekeurd en hoe te verkrijgen?
Laatst bijgewerkt: 15 juli 2024
U kunt legaal toegang krijgen tot nieuwe geneesmiddelen, zelfs als ze niet zijn goedgekeurd in uw land.
Leer hoeEnhertu (fam-trastuzumab deruxtecan-nxki) is sinds de eerste goedkeuring door de FDA in 2019 1 een van de kankerbehandelingen om in de gaten te houden.
De veiligheid en werkzaamheid van Enhertu bij eierstokkanker en colorectale kanker worden nog onderzocht, maar het medicijn is al goedgekeurd voor verschillende indicaties. Waaronder HER2-positieve borstkanker, HER2-positieve maagkanker en HER2-arme borstkanker. De FDA heeft ook Enhertu goedgekeurd voor HER2-mutante niet-kleincellige longkanker. Het CHMP in Europa heeft onlangs een positief advies gegeven om hetzelfde te doen binnen de EU 2.
Als je longkankerpatiënt bent in het Verenigd Koninkrijk of elders buiten de VS en de EU, vraag je je waarschijnlijk af wanneer Enhertu ook voor jou beschikbaar zal zijn.
Dit is alles wat je moet weten over Enhertu voor longkanker en wat patiënten in het Verenigd Koninkrijk en de rest van de wereld kunnen verwachten.
Wat is de indicatie voor Enhertu voor longkanker?
Als gerichte therapie is Enhertu alleen bedoeld voor de behandeling van kankers met een HER2-mutatie. Als zodanig is de behandeling van toepassing op ongeveer 2% van alle NSCLC-patiënten 3.
Enhertu is geïndiceerd als monotherapie bij volwassen patiënten met gevorderd NSCLC bij wie de tumor een activerende HER2-mutatie (ERBB2) heeft. Enhertu is bedoeld voor patiënten die een eerdere systemische behandeling hebben gekregen en bij wie de kanker is uitgezaaid naar andere delen van het lichaam of niet operatief kan worden verwijderd 2.
Wat is het succespercentage van Enhertu voor longkanker?
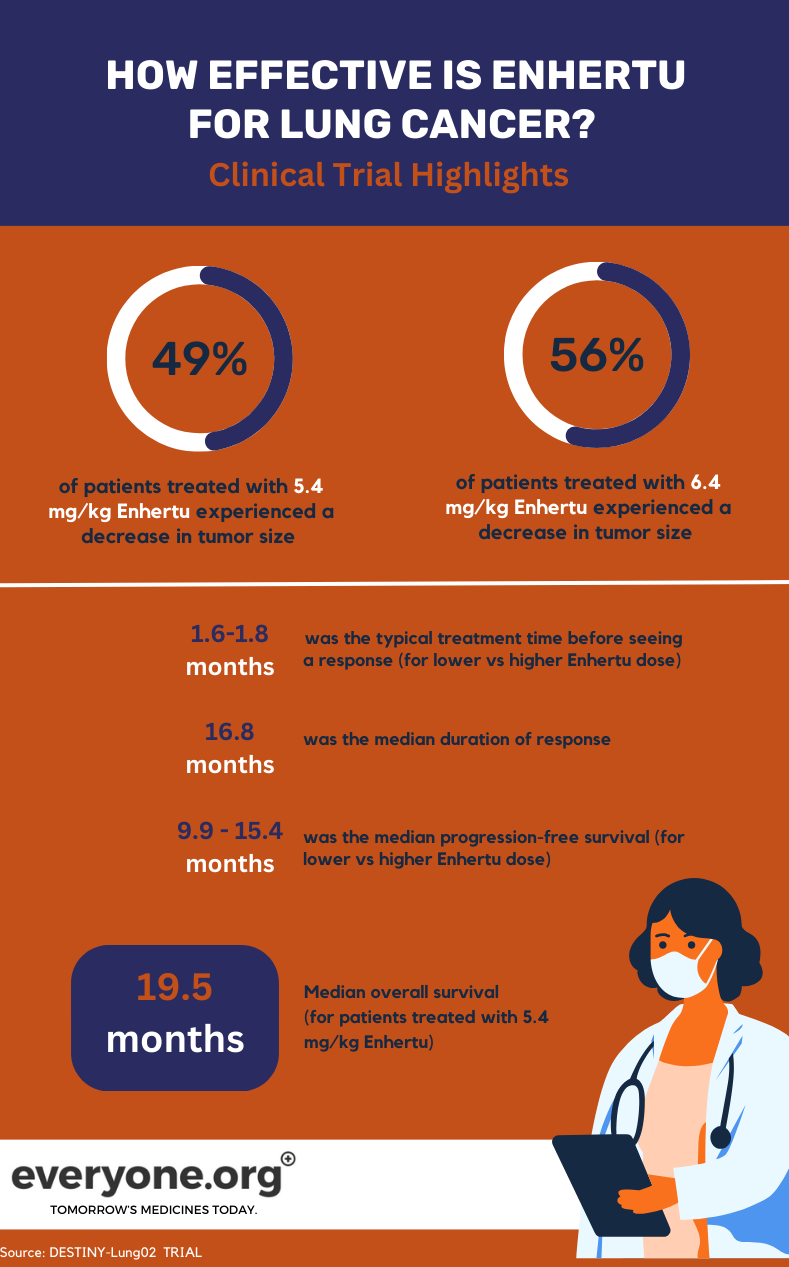
De lopende DESTINY-Lung02 Fase II studie onderzoekt de veiligheid en efficiëntie van Enhertu bij de behandeling van HER2-gemuteerd NSCLC. In de studie worden twee doses Enhertu (5,4 mg/kg en 6,4 mg/kg) vergeleken.
Voor longkankerpatiënten zijn de belangrijkste voorlopige resultaten van de DESTINY-Lung02 studie:
- Tumoren krompen bij 49% van de patiënten die werden behandeld met de lagere dosis Enhertu en bij 56% van de patiënten die werden behandeld met de hogere dosis.
- Tumoren verdwenen volledig bij respectievelijk 1% en 4% van de patiënten in de lagere en hogere dosisgroep.
- De mediane duur van de respons was 16,8 maanden voor patiënten in de lagere Enhertu dosisgroep. Voor patiënten in de andere groep werd de DoR gerapporteerd als niet te schatten.
- De mediane tijd die nodig was om een initiële behandelingsrespons waar te nemen, was respectievelijk 1,8 maanden en 1,6 maanden in de groep met de lagere en hogere dosering.
- De mediane progressievrije overleving was 9,9 maanden bij 5,4 mg/kg en 15,4 maanden bij 6,4 mg/kg 4.
Wat was de mediane overleving voor Enhertu patiënten?
Voor patiënten die de lagere dosis Enhertu kregen in de klinische studie, was de mediane totale overleving (OS) 19,5 maanden. De OS werd gerapporteerd als niet te schatten voor de hogere dosis groep 4.
Wat zijn de bijwerkingen van Enhertu op de longen?
Er zijn enkele ernstige, levensbedreigende of fatale gevallen van interstitiële longziekte (ILD) gemeld bij Enhertu patiënten. Patiënten met matige nierinsufficiëntie kunnen een hoger risico lopen 6.
Binnen de DESTINY-Lung02 studie werd ILD gerapporteerd bij 12,9% van de patiënten in de lagere doseringsgroep en bij 28% van de patiënten in de hogere doseringsgroep. De meerderheid van deze gevallen was niet ernstig. ILD van graad 3 of hoger werd gemeld bij 2% van de patiënten in beide patiëntengroepen.
EnhertuHet veiligheidsprofiel voor longkanker is vergelijkbaar met de prestaties bij andere indicaties. Op basis van de lagere incidentie van bijwerkingen (38,6% vs 58%) wordt de dosis van 5,4 mg/kg beschouwd als de optimale behandeling voor NSCLC-patiënten 4.

Waar is Enhertu goedgekeurd voor longkanker?
Momenteel is Enhertu goedgekeurd in de VS, EU, Israël en Japan voor de behandeling van volwassen patiënten met niet-resectabel of metastatisch NSCLC bij wie de tumor een activerende HER2-mutatie (ERBB2-mutatie) 4 heeft.
Is Enhertu goedgekeurd voor longkanker in het VK?
Vanaf juli 2024 nog niet. Een definitieve ontwerprichtlijn die in maart 2024 door NICE werd gepubliceerd, kondigde aan dat Enhertu niet op de NHS beschikbaar zal zijn totdat er een kosteneffectieve prijs beschikbaar is. In de tussentijd is Enhertu helaas niet beschikbaar in het VK voor longkanker 7.
Kan mijn arts Enhertu voor longkanker voorschrijven als het nog niet is goedgekeurd?
Het korte antwoord is ja.
Enhertu is al in meerdere landen goedgekeurd voor de behandeling van HER2-gemuteerd NSCLC. Op basis hiervan heeft uw arts de bevoegdheid om het geneesmiddel voor deze indicatie voor te schrijven, zelfs als het in uw land nog niet is goedgekeurd.
Als een arts een medicijn voorschrijft voor de behandeling van een ziekte waarvoor het (nog) niet is goedgekeurd, dan heet dat off-label gebruik. Een recept voor off-label gebruik kan in sommige landen moeilijk in te vullen zijn, afhankelijk van de lokale regelgeving en beschikbaarheid. Het is echter altijd mogelijk om het te vullen met behulp van de Named Patient Import regeling.
Heeft je arts besloten om Enhertu voor te schrijven voor de behandeling van je longkanker? Ons team op www.everyone.org kan u helpen toegang te krijgen tot het geneesmiddel. Wij zijn gespecialiseerd in het vinden en leveren van voorgeschreven geneesmiddelen die niet zijn goedgekeurd of niet beschikbaar zijn in het land van de patiënt. Neem contact met ons op, zodat we u kunnen helpen.
Referenties:
- Stewart, Judith. Enhertu (fam-trastuzumab deruxtecan-nxki) FDA Goedkeuringsgeschiedenis. Drugs.com, 15 augustus 2022.
- Enhertu. Europees Geneesmiddelenbureau, geraadpleegd op 06 november 2023.
- HER2 en longkanker. American Lung Association, geraadpleegd op 6 november 2023.
- Enhertu toonde sterke en duurzame tumorresponsen in eerder behandelde HER2-mutante gevorderde longkanker in DESTINY-Lung02 Fase II studie. AstraZeneca, 11 september 2023.
- Projectinformatie | Trastuzumab deruxtecan voor de behandeling van HER2-gemuteerde niet-resectabele of gemetastaseerde niet-kleincellige longkanker na 1 of meer therapieën [ID3934] | Richtlijn. NICE, geraadpleegd op 6 november 2023.
- USPI-DB-04 CDX Update FINAL. Daiichi Sankyo, geraadpleegd op 6 november 2023.
- UK NICE wijst Daiichi Sankyo's Enhertu voor borstkanker af, Pharmaceutical Technology, Geraadpleegd op 15 juli 2024.